La demenza frontotemporale (FTD) è una forma comune di demenza, con caratteristiche cliniche e neuropatologiche eterogenee. Dal punto di vista clinico, i segni e sintomi della patologia si manifestano nella tarda età adulta, colpendo ugualmente uomini e donne. I pazienti mostrano progressive alterazioni nel comportamento, nelle funzioni esecutive e nel linguaggio; queste alterazioni risultano da un fenomeno di neurodegenerazione che coinvolge principalmente i lobi frontali e temporali.
La causa più comune di degenerazione lobare è rappresentata da deposizioni tossiche di specifiche proteine, motivo per cui la demenza frontotemporale viene spesso definita come proteinopatia. Così come per altre malattie neurodegenerative, nonostante lo sforzo della comunità scientifica nel settore, i meccanismi patogenetici di questa forma di demenza rimangono ad oggi in gran parte sconosciuti e non sono disponibili farmaci in grado di bloccare o rallentare la progressione della malattia.
Negli ultimi anni, numerose evidenze sperimentali hanno suggerito come alterazioni del sistema immunitario, possano svolgere un ruolo patogenetico rilevante. Inoltre, diversi studi hanno dimostrato il coinvolgimento di vari sistemi neurotrasmettitoriali, primo tra questi il glutammato. Recentemente, autoanticorpi diretti contro la subunità 3 del recettore per il glutammato AMPA (GluA3) sono stati identificati in circa il 25% di pazienti affetti da FTD.
Dato il già dimostrato coinvolgimento tanto del sistema immunitario, quanto del sistema glutammatergico, nella patogenesi della demenza frontotemporale, la presenza di autoanticorpi diretti contro GluA3 in una percentuale così alta di pazienti affetti da FTD ha suscitato interesse e attenzione, suggerendo come gli autoanticorpi stessi possano rappresentare un trigger o un fattore peggiorativo per la patologia.
Dal punto di vista clinico, è stato dimostrato come i pazienti positivi per questi auto-anticorpi siano caratterizzati da una ridotta trasmissione glutammatergica se comparati ai pazienti negativi; inoltre, l’analisi post-mortem di campioni di corteccia temporale ha dimostrato come questa disfunzione sia accompagnata da alterazioni in termini di composizione del recettore AMPA. Infine, alcuni aspetti comportamentali propri della patologia (quali impulsività o perdita di interesse) risultano accentuati nei pazienti FTD positivi per gli auto-anticorpi contro GluA3.
Date queste premesse, il progetto a cui partecipo, nel laboratorio di Farmacologia della Neurodegenerazione coordinato da Monica Di Luca e Fabrizio Gardoni, ha come scopo quello di investigare il ruolo svolto dagli autoanticorpi contro GluA3 nella patogenesi della FTD.

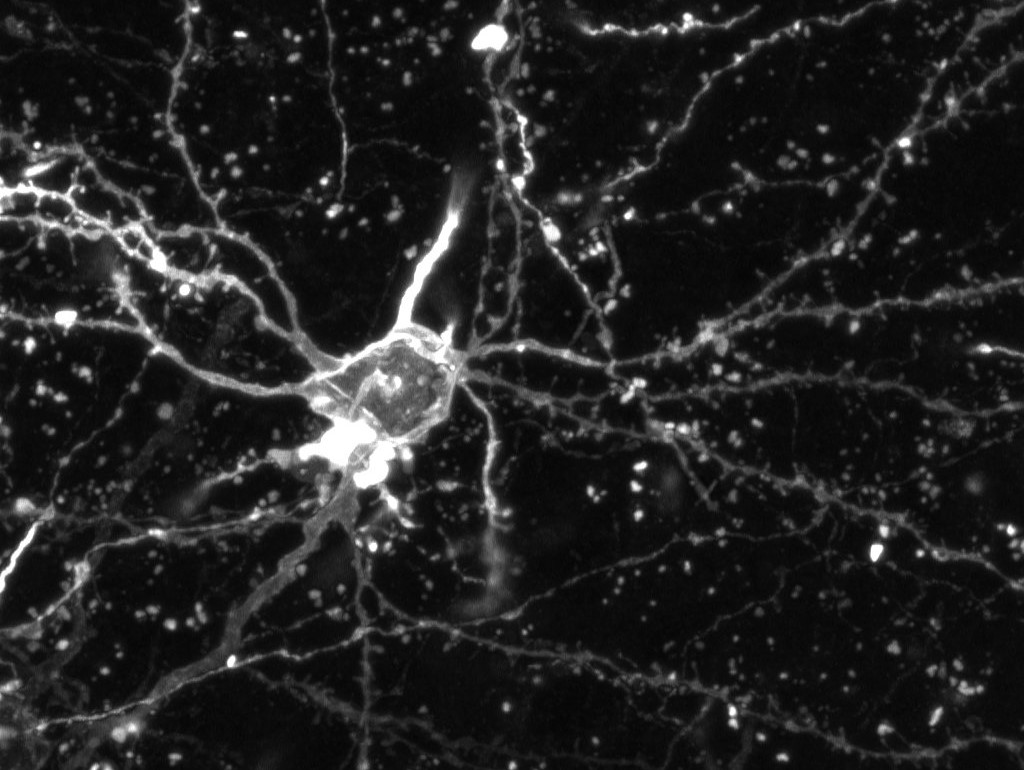
Con questa finalità, il progetto utilizza un modello sperimentale di somministrazione cronica di auto-anticorpi diretti contro GluA3, isolati da pazienti affetti da FTD. Il progetto consiste nella valutazione di tutte le alterazioni a livello molecolare e a livello comportamentale indotte dalla presenza degli auto-anticorpi. Dal punto di vista molecolare, stiamo studiando alterazioni proprie del sistema glutammatergico, quali alterazioni della composizione del recettore AMPA (e pathways ad esso legati) o alterazioni morfologiche delle spine dendritiche (i.e., alterazioni in numero e struttura delle sinapsi). Al contempo, stiamo analizzando aspetti comportamentali legati alla patologia FTD e, nello specifico, ci concentriamo sui comportamenti tipici dei pazienti FTD positivi per gli auto-anticorpi, quali impulsività e apatia.
Lo sviluppo e la caratterizzazione del modello cronico sono di grande interesse e rilevanza per due ragioni. In primo luogo, l’analisi delle alterazioni proprie del modello permetterà di valutare gli effetti tossici indotti dalla presenza dell’autoanticorpo e, potenzialmente, nei pazienti. Per quanto il modello scelto descriva unicamente la presenza cronica degli anticorpi e non sia, almeno in senso stretto, un modello della patologia FTD, esso consente di separare e possibilmente identificare il contributo specifico degli autoanticorpi stessi alla neuropatologia.
Completata la caratterizzazione del modello, esso potrà essere inoltre utilizzato per la valutazione di possibili strategie terapeutiche specifiche per i pazienti positivi per gli autoanticorpi diretti contro GluA3. Quest’ultimo punto è di particolare rilevanza considerando che, come indicato anche precedentemente, non sono ad oggi disponibili terapie farmacologiche approvate per pazienti affetti da FTD in grado di bloccare o anche solo rallentare il decorso clinico.
Lascia un commento