È ormai passato un anno da quando il responsabile del mio laboratorio ha ricevuto l’invito per presentare un lavoro su Frontiers in Chemistry, una rivista open access che progettava un numero speciale sui trasportatori di membrana come possibili bersagli di nuovi farmaci.
Come sempre quando riceviamo proposte particolari abbiamo fatto un piccolo briefing di laboratorio. Io stavo sorseggiando del caffè quando Ivano ha proposto che fossi io ad occuparmi principalmente del lavoro. Ho sentito una grande responsabilità e anche un po’ di timore perché avevo appena iniziato il mio secondo anno di dottorato e la scadenza per presentare il lavoro sarebbe stata da lì a pochi mesi.
Una cosa però mi rassicurava molto: lo sguardo deciso di tutti i miei colleghi che da subito mi hanno aiutato a focalizzare l’obiettivo. Una manciata di minuti e avevamo già deciso: “Proviamo a simulare i cambiamenti conformazionali di LAT1 durante il trasporto di un amminoacido e parallelamente ad osservare il suo comportamento in presenza di un inibitore del trasporto”, ha detto Chiara, una collega dalla quale ho appreso molto nel corso di questi anni al Laboratorio di Biochimica e Biofisica Computazionale. Sapevo che se vedeva una strada di ricerca percorribile, questa poteva essere percorsa.
LAT1, o meglio L-type amino acid transporter 1, è un trasportatore di membrana coinvolto nell’assorbimento degli aminoacidi essenziali ed è molto espresso nei tumori, caratterizzati appunto da un aumento della domanda di aminoacidi. LAT1 è stato recentemente riconosciuto come un nuovo bersaglio per la terapia del cancro ed, essendo anche espresso nella barriera ematoencefalica, gioca un ruolo importante nel transito di aminoacidi e di alcuni farmaci anticonvulsivanti. Studiare il meccanismo di trasporto mediato da LAT1 è quindi molto importante per poter poi sviluppare molecole selettive, in grado di bloccare LAT1 o esserne trasportate.
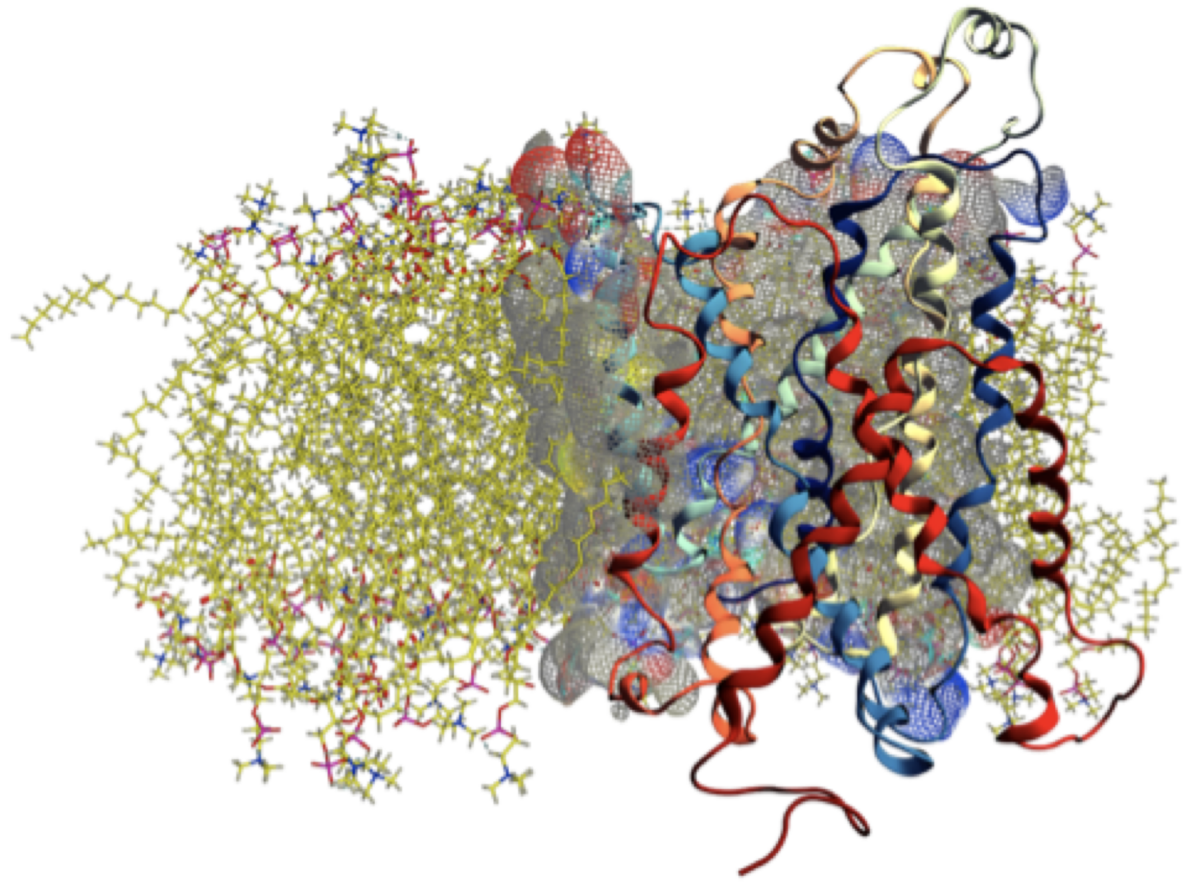
Poiché la struttura tridimensionale di LAT1 non è ancora stata risolta con metodi sperimentali, il nostro primo passo è stato quello di costruirne un modello a livello atomico, partendo dalla struttura tridimensionale di due proteine omologhe, la prima risolta in una conformazione aperta verso il compartimento extracellulare (OF) la seconda invece verso quello intracellulare (IF).
Successivamente, abbiamo inserito il nostro modello nella membrana cellulare. Una membrana virtuale, ovviamente, perché nel nostro laboratorio trattiamo le proteine in silico, cioè attraverso il computer. Aggiungendo acqua e sale q.b., abbiamo poi equilibrato il tutto attraverso una simulazione di dinamica molecolare, grazie alla quale abbiamo potuto osservare il movimento di tutti gli atomi, lasciati liberi di muoversi all’interno del nostro sistema.
La parte difficile di questo lavoro è stata l’applicazione di una particolare tecnica di dinamica molecolare, definita targeted, per osservare i cambiamenti conformazionali dalla forma OF alla forma IF. Qualche settimana di studio, qualche riga scritta in un particolare linguaggio di programmazione e subito il primo success… ehm, fallimento. Le simulazioni con i due soluti trasportati e con l’inibitore di LAT1 si bloccavano senza arrivare a conclusione.
Panico, caffè e poco dopo ho scoperto che avevo solamente scritto male parte dei codici della simulazione. Trovato l’errore, abbiamo lanciato le simulazioni sulle schede grafiche del nostro computer e per un paio di settimane ci siamo rilassati – per modo di dire – occupandoci degli altri lavori che nel frattempo si erano accumulati sulla scrivania.
Ero in bicicletta e pedalavo verso l’ufficio quando mi è arrivato il messaggio di Tommaso, anche lui dottorando del nostro laboratorio, che diceva “Luca, le tue dinamiche sono finite. Posso riavviare la macchina che mi servirebbe per le mie simulazioni?”.
Ovviamente prima di farlo avvicinare al calcolatore ho voluto guardare tutte le simulazioni.
Erano venute proprio bene, lo ammetto. Riuscivamo a discriminare il comportamento del nostro trasportatore quando questo trasportava un soluto, ovvero una molecola che sappiamo essere trasportata da dati sperimentali, rispetto a quando invece interagiva un inibitore, ovvero una molecola capace di bloccare il meccanismo di trasporto. E quindi via, con tutta una serie di analisi energetiche e strutturali delle varie simulazioni; codici, altri codici e una manciata di grafici da interpretare dal punto di vista biochimico, incrociando dati di trasporto misurati su sistemi cellulari da Cesare Indiveri, rinforzati da ulteriori dati pubblicati negli ultimi anni.
Abbiamo steso quindi il manoscritto, cercando di mettere ben in evidenza come queste particolari tecniche utilizzate, oltre che essere particolarmente innovative per l’ambito di studio, restituissero molto bene i risultati biochimici.
Quando abbiamo inviato il manoscritto alla rivista, eravamo lievemente agitati: mancava infatti pochi minuti alla scadenza della procedura on-line ed eravamo in attesa della fine del rendering di tutti i video delle nostre simulazioni, perché non mi ero accorto che il formato richiesto non era quello che avevo generato con i programmi di dinamica molecolare. Uliano, un nostro collega che ha la passione per la fotografia ed i video, molto tranquillamente ha estratto dal cilindro un convertitore che faceva proprio al caso nostro. Ore 17.49, lavoro sottomesso con ben 11 minuti di anticipo!
La primavera, oltre che aver portato le rondini, ha portato anche le revisioni del nostro manoscritto. La pubblicazione di un lavoro scientifico è soggetta infatti a peer-review (o revisione tra pari), in cui ricercatori internazionali esperti dell’argomento giudicano il lavoro e suggeriscono come implementare o colmare alcuni aspetti. Nel nostro caso, abbiamo dovuto estendere alcune simulazioni e soprattutto analizzare nel dettaglio alcune interazioni energetiche tra i soluti, l’inibitore e LAT1. Queste simulazioni aggiuntive, chieste da uno dei revisori, insieme ai vari approfondimenti ci hanno permesso di rinforzare la nostra idea originaria, consentendoci sia di pubblicare un articolo completo sia di ottenere modelli delle strutture tridimensionali di LAT1 in diverse conformazioni, utili per programmare esperimenti di laboratorio sul sistema LAT1 e soprattutto per comprendere meglio i meccanismi che consentono ad una piccola molecola di passare attraverso questo particolare trasportatore.
È ormai passato un anno da quando Ivano mi ha chiesto di studiare LAT1 e da sei giorni ho una nuova missione, quella di studiare un altro trasportatore: SLC6A14.
Sono certo che questa sarà una delle mie prossime storie.
Lascia un commento