Mi chiamo Alyssa Paganoni, una studentessa al secondo anno del dottorato in Scienze Farmacologiche Biomolecolari, Sperimentali e Cliniche. Sto svolgendo la mia attività di ricerca presso il laboratorio di Neurobiologia dello Sviluppo, coordinato da Anna Cariboni. Il focus principale del laboratorio è quello di capire i meccanismi cellulari e molecolari che controllano lo sviluppo dei neuroni GnRH-secernenti che regolano l’asse riproduttivo. Difetti nello sviluppo di tali neuroni rappresentano infatti una delle cause di disordini genetici caratterizzati da deficit di GnRH, quali l’ipogonadismo ipogonadotropo, la sindrome di Kalmann e la sindrome CHARGE.
Nei mammiferi, la riproduzione sessuale è controllata dal rilascio dell’ormone GnRH, che è prodotto da un piccolissimo numero di neuroni (un migliaio circa nel cervello umano). Durante lo sviluppo embrionale, questi particolari neuroni originano nel placode nasale e migrano poi, attraverso il setto nasale, nel proencefalo per raggiungere la loro destinazione finale, l’ipotalamo. Una volta qui, estendono i propri assoni all’eminenza mediana, dove rilasciano il GnRH nei vasi sanguigni dell’ipofisi per stimolare la produzione di gonadotropine.
Difetti nello sviluppo, migrazione o secrezione dei neuroni GnRH sono una delle cause della mancanza di GnRH, con conseguente assenza o ritardo della pubertà. Questi sono i segni distintivi dell’ipogonadismo ipogonadotropo, le cui cause genetiche sono largamente sconosciute. Una delle maggiori difficoltà nello studiare lo sviluppo di questi neuroni risiede nel fatto che sono pochi, migrano in una finestra temporale ristretta e mancano di marker specifici per identificarli.
In questo articolo ho deciso di parlarvi di un progetto in collaborazione con Paolo Magni (DiSFEB) e Rossella Cannarella (Università di Catania) riguardante il ruolo dell’ormone antimulleriano (AMH), l’ormone della crescita (GH) e il fattore di crescita insulino-simile (IGF1) nel sistema GnRH.
Recenti studi hanno messo in evidenza come l’AMH possa giocare un ruolo nella patogenesi dell’ipogonadismo ipogonadotropo, aiutando a discriminare e questa condizione dalla pubertà ritardata. Anche GH e IGF1 potrebbero essere coinvolti nella funzione dei neuroni GnRH-secernenti, dal momento che la pubertà ritardata è sintomo comune in pazienti con mancanza di GH o sindrome di Laron, una forma genetica di resistenza al GH.
Comprendere gli stimoli che modulano la migrazione e la secrezione dei neuroni GnRH-secernenti può fare luce sulle cause della pubertà ritardata o dell’ipogonadismo ipogonadotropo. Tuttavia, finora erano pochi gli studi riguardanti il ruolo del sistema GH-IGF1 sulla migrazione e secrezione dei neuroni GnRH. Allo stesso modo, anche il ruolo fisiologico dell’AMH e del suo recettore nella vita postnatale e, in particolare, dalla nascita alla pubertà, è poco noto.
In questo lavoro abbiamo quindi utilizzato modelli di neuroni immaturi (linea cellulare GN11) e maturi (GT1-7) immortalizzati con lo scopo di chiarire il ruolo di AMH, GH e IGF1 su migrazione e funzionalità dei neuroni GnRH-secernenti. Abbiamo incubato le cellule con concentrazione crescenti dei tre ormoni e abbiamo valutato la migrazione e la secrezione di GnRH.
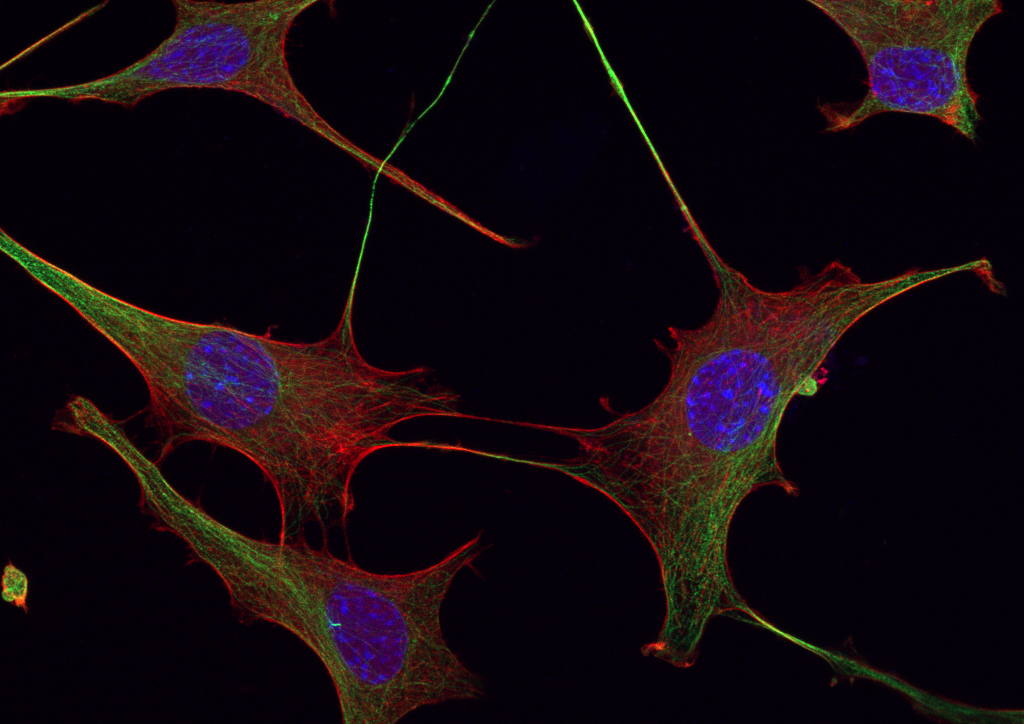
Per valutare la migrazione neuronale, abbiamo utilizzato un saggio di chemiotassi con concentrazioni crescenti dei tre ormoni, riscontrando un aumento della migrazione in maniera dose-dipendente. Dal momento che i rimodellamenti del citoscheletro sono essenziali durante la migrazione, per capire i possibili effetti di AMH, GH e IGF1, abbiamo marcato actina e tubulina con molecole fluorescenti. Tutti e tre gli ormoni inducono dei cambi morfologici. Nello specifico, dopo il trattamento, le GN11 risultano essere più allungate, come è tipico dei neuroni in fase di migrazione.
Infine, abbiamo valutato l’effetto di AMH, GH e IGF1 sulla secrezione di GnRH, e abbiamo visto come AMH e GH stimolino la secrezione di GnRH in maniera dose dipendente. IGF1 sembra invece aumentare il rilascio del GnRH immagazzinato in vescicole, piuttosto che la sua sintesi.
Questo lavoro mostra come AMH, GH e IGF1 supportino la chemomigrazione delle GN11 e la stimolazione della secrezione di GnRH nelle cellule GT1-7. Per quanto riguarda le possibili implicazioni terapeutiche, nessuno studio ha indagato il ruolo dell’AMH come agente terapeutico per il trattamento dell’ipogonadismo ipogonadotropo o del ritardo della pubertà, probabilmente perché i dati scientifici della sua influenza sui neuroni GnRH è stata evidenziata solo di recente. Il trattamento con IGF1 è molto raramente prescritto, essendo riservato ai pazienti con resistenza al GH. In contrapposizione, GH è disponibile terapeuticamente e viene prescritto per il trattamento di pazienti con deficit dell’ormone della crescita (GHD) e merita di essere studiato nei casi di pubertà ritardata o ipogonadismo ipogonadotropo non legato a GHD.
Per leggere il lavoro completo potete cliccare sul seguente collegamento all’articolo scientifico.
Lascia un commento