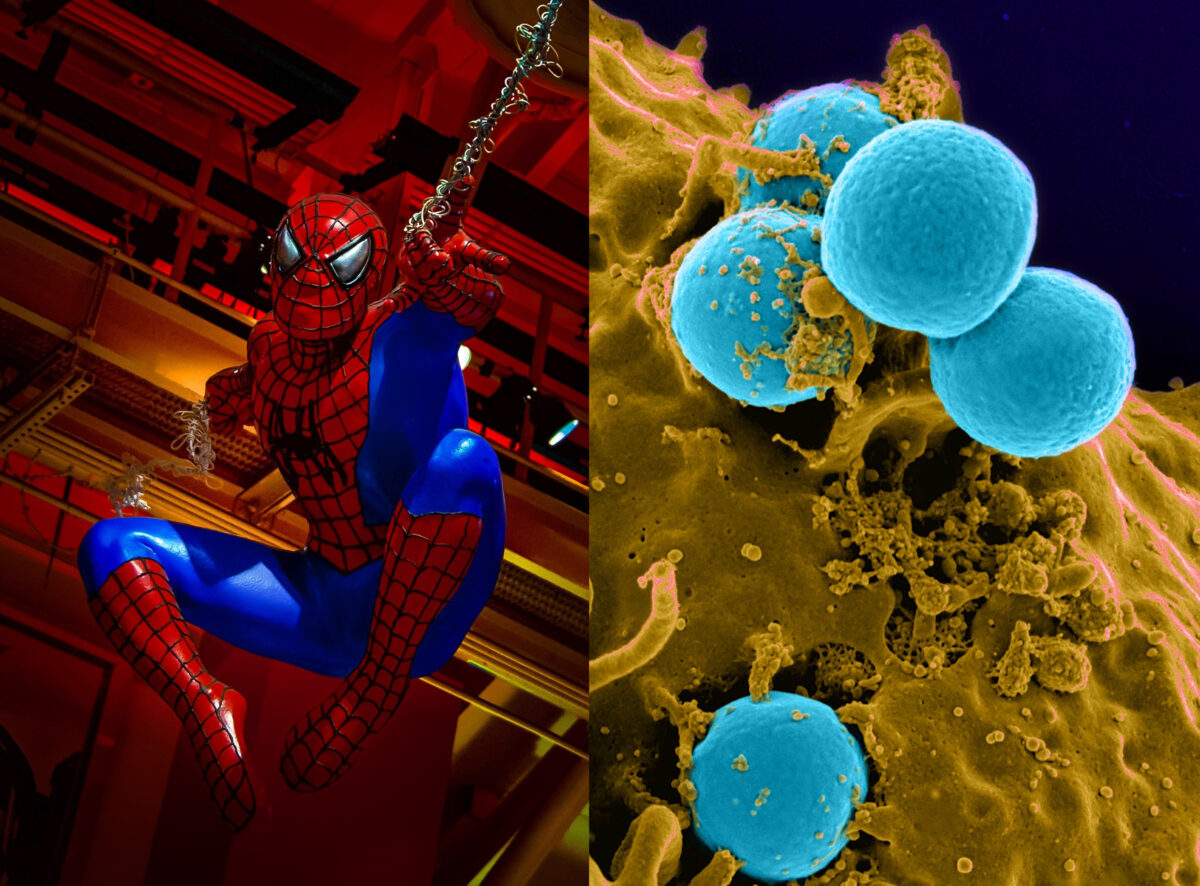
I am always the first to arrive on the scene of infection, the dark side can easily turn me against the human body that I protect. I live a short life, but when I fight during that short life, I fight the infection with all my might.
Una frase come questa è capace di conferire un’allure di eroismo anche a delle semplici cellule, tanto studiate in diversi ambiti della fisiopatologia e dell’immunologia. A rileggere una seconda volta, con attenzione, questa frase, è facile intuire che stiamo parlando di neutrofili.
Sì, perché in effetti sappiamo che sono proprio loro i primi ad arrivare sul luogo del “crimine”, dove sono ancora presenti i cattivi (batteri, funghi o i loro prodotti patogeni). Appena arrivati sul posto, proprio come sa fare Spiderman, scagliano contro i nemici una trappola micidiale, chiamata in biologia “NET” (Neutrophil Extracellular Trap). Questa è una rete di DNA e proteine utili per contrastare l’attività dei microorganismi, la loro diffusione e a facilitarne la rimozione.
Così numerosi (rappresentano infatti fino al 70% di tutte le cellule bianche), i neutrofili dominano i vasi sanguigni e raggiungono ogni estremità del nostro corpo nelle poche ore della loro esistenza. Sembra davvero strano, eppure l’organismo permette un dispendio importante di energia per produrre tutte queste spidercell così attive che, almeno da quanto sappiamo, vivono in circolo nell’arco di ore, per poi tornare in organi deputati al loro centro di raccolta ed eliminazione (la milza). Pur tuttavia, durante questo loro viaggio, recenti dati mostrano come alcuni di essi entrino nei linfonodi, e vi rimangano per periodi più lunghi, per poi essere pronti a rientrare in gioco al primo segnale di allarme. La motivazione di questo soggiorno in quegli antri bui, ma che continuano a suscitare interesse scientifico, risulta ancora poco chiara.
Ad oggi, ci sono sempre più evidenze di un coinvolgimento importante di queste cellule nell’ambito dell’aterosclerosi, non soltanto in modelli sperimentali ma anche in studi epidemiologici. Infatti, è stato recentemente pubblicato uno studio prospettico inglese, condotto su oltre 400.000 soggetti, in cui elevati livelli circolanti di neutrofili erano correlati con un significativo aumento dell’incidenza di eventi cardiovascolari (fatali e non) su base ischemica (ovvero quelle scatenate dal fenomeno dell’aterosclerosi) in un periodo di osservazione di sette anni.
Il dato, oltre che rilevante e significativo, risulta essere anche curioso. Sorge spontanea, infatti, la domanda su quali possano essere le spiegazioni di questa relazione tra un fenomeno patologico notoriamente cronico (l’aterosclerosi, appunto) e l’aumento del numero di cellule caratterizzate da una vita molto breve. Inoltre, almeno fino ad oggi, siamo certi che queste cellule non sono dotate di quella memoria immunitaria che caratterizza invece altre linee cellulari (vedasi i linfociti).
È stato di recente proposto che i neutrofili stessi siano richiamati all’interno delle lesioni aterosclerotiche da altre cellule a loro molto simili (i monociti), a loro volta attivate da stimoli e meccanismi pro-infiammatori legati all’accumulo di colesterolo (ancora una volta proprio questa molecola!).
Dobbiamo ancora capire quali siano i meccanismi alla base di queste interazioni e se, questi stessi, diluiti nel tempo, rendano ragione della manifestazione clinica del fenomeno aterosclerotico, attraverso la manifestazione di eventi cardiovascolari noti a tutti, quali infarto e ictus.
Non è nemmeno da escludere la rilevanza di fenomeni epigenetici a carico di queste cellule dopo il loro primo contatto con i cattivi, ovvero la comparsa di modificazioni a carico di specifiche regioni del DNA trasmesse alle generazioni successive, rendendole sempre più facilmente attivabili. Questi aspetti spiegherebbero un tipo di memoria immunitaria totalmente differente da quella canonica, che siamo abituati a studiare sui libri, dominata dai linfociti e il cui ruolo è stato ampiamente consolidato in ambito cardiovascolare.
Tutti questi aspetti sono temi centrali di progetti finanziati, uno da Fondazione Cariplo e un altro, chiamato Reprogram (Targeting epigenetic REPROGRamming of innate immune cells in Atherosclerosis Management and other chronic inflammatory diseases), e finanziato dal programma di ricerca della Commissione Europea Horizon 2020.
Lascia un commento