Il dogma centrale della biochimica strutturale è incentrato sul seguente concetto:una singola funzione biologica di una proteina dipende da una specifica struttura tridimensionale, ovvero, la funzione di una proteina è una conseguenza della sua conformazione, che dipende a sua volta dagli amminoacidi che la compongono e da come sono ordinati.
Tuttavia, ci si sta rendendo conto che esistono delle proteine che si comportano in modo non convenzionale. Si chiamano infatti proteine intrinsecamente disordinate (IDP) quelle dotate di funzioni indipendenti dalla loro struttura. Le IDP possono esistere anche come ibridi (IDPR), ovvero proteine dotate di una struttura tridimensionale stabile e ben definita ma che contengono delle regioni non strutturate, intrinsecamente disordinate.
Sia IDP che IDPR si trovano abbondantemente in natura e fanno parte del proteoma (l’insieme delle proteine) degli organismi in tutti i regni dei viventi, nonché dei virus. Non solo, ma l’abbondanza di IDP sembra essere proporzionale alla complessità dell’organismo, in quanto tali proteine svolgono un ruolo essenziale nel”signaling” cellulare, ovvero in quei meccanismi che consentono ad una cellula di processare le informazioni provenienti dallo stato interno della cellula e dall’ambiente circostante.
In realtà queste proteine “anomale” sono conosciute da tempo, ma si pensava si trattasse di eccezioni rispetto al modello “chiave-serratura” più classico, ma data la loro abbondanza in natura e l’importanza di molti dei processi biologici a cui partecipano, oggi sono considerate una vera e propria classe di proteine che ha richiamato a sè molto interesse.
Le IDP, o i domini disordinati, sono caratterizzati da una maggior semplicità in termini di composizione e sequenza amminoacidica (ricca di aminoacidi idrosolubili e carichi) tuttavia, poiché non necessitano di raggiungere una conformazione fissa, esistono molte più combinazioni di sequenza possibili per le IDP, rispetto alle “proteine ordinate”. Questo perché il numero di combinazioni di aminoacidi che possono generare strutture stabili e ordinate è inferiore rispetto a tutte quelle possibili.
Una caratteristica importante delle IDP, è la loro eterogeneità, infatti esse possono acquisire una o diverse conformazioni ordinate in determinate circostanze (come l’interazione con un altra proteina), oppure no..
Ciò dipende dalla loro energia in funzione della loro conformazione: mentre per le proteine ordinate esiste un “minimo energetico”, ovvero un punto di stabilità, legato a una specifica conformazione, questo non accade per le IDP e IDPR, dove l’energia varia pochissimo al variare della struttura, rendendo la loro esistenza possibile all’interno di un vasto campo conformazionale.
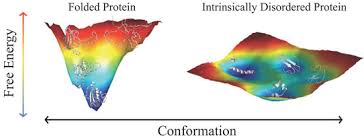
La semplicità intrinseca di queste proteine, però, permette alle IDP e IDPR di svolgere funzioni molto complesse: infatti grazie alla variabilità della loro conformazione possono interagire con una moltitudine di altre proteine per regolarne la funzionalità. Inoltre, le “proteine ordinate” sono molto delicate, in quanto la perdita di conformazione dovuta a fattori esterni, come pH e temperatura, ne compromette l’attività, ma diverse IDP acquisiscono una struttura più ordinata proprio in presenza di condizioni “estreme”, permettendo a IDP o IDPR di svolgere funzioni altrimenti impossibili per le proteine strutturate.
Data la quantità e complessità dei processi fisiologici in cui sono coinvolte, comprendere a fondo i meccanismi del funzionamento delle IDP e IDPR e come queste interagiscono con altre macromolecole è fondamentale, non solo per comprendere a fondo la biologia a livello molecolare, ma anche per comprendere le basi molecolari di patologie e sviluppare farmaci in grado di regolare l’attività di questa “nuova” e “anomala”classe di proteine.
Ad esempio, infatti, la β-Amiloide e l’α-sinucleina sono proteine intrinsecamente disordinate coinvolte in gravi patologie neurodegenerative, come Parkinson e Alzheimer, malattie per le quali ancora non esistono trattamenti farmacologici risolutivi.
Lascia un commento